ناهنجاریهای مادرزادی عروقی: یک مرور جامع
مقدمه
ناهنجاریهای مادرزادی عروقی بخشی از گروه بیماریهای نادر اما بالینی مهم هستند که در اثر اختلال در تکامل و سازماندهی شبکه عروقی جنین ایجاد میشوند. این بیماریها میتوانند از یک لکه پوستی ساده تا ضایعات پیچیدهای که حیات بیمار را تهدید میکنند، طیف گستردهای از تظاهرات بالینی را شامل شوند. با وجود شیوع پایین، تأثیر قابل توجه آنها بر کیفیت زندگی، عملکرد اعضا، و حتی بروز عوارض کشنده، موجب شدهاند که طی سالهای اخیر مورد توجه ویژه پزشکان، پژوهشگران و سیاستگذاران سلامت قرار گیرند. درک صحیح از طبقهبندی، پاتوفیزیولوژی و درمان این ناهنجاریها شرط اصلی ارائه مراقبت مناسب به بیماران است.
تاریخچه و طبقهبندی ISSVA
تا اوایل قرن بیستم، بسیاری از ضایعات عروقی تحت عنوان کلی «همانژیوم» شناخته میشدند. این امر باعث سردرگمی در تشخیص، درمان و گزارش نتایج میگردید. با پیشرفت علم آسیبشناسی و تصویربرداری، تفاوت اساسی میان تومورهای عروقی و ناهنجاریهای عروقی مشخص شد. نقطه عطف این مسیر، طبقهبندی انجمن بینالمللی مطالعه ناهنجاریهای عروقی (ISSVA) بود که نخستینبار در دهه ۱۹۹۰ تدوین شد و تاکنون چندین بار بازبینی شده است. این طبقهبندی ناهنجاریهای عروقی را به دو دسته اصلی تقسیم میکند:
- تومورهای عروقی مانند infantile hemangioma که با رشد تکثیری سلولی مشخص میشوند.
- مالفرمیشنهای عروقی که اختلالات ساختاری پایدار بوده و همراه با تکثیر سلولی فعال نیستند.
این تقسیمبندی نهتنها نظم جدیدی به درک ما از این بیماریها داده، بلکه پایهگذار الگوریتمهای تشخیصی و درمانی استاندارد شده است.
اپیدمیولوژی و بار بیماری
شیوع کلی ناهنجاریهای عروقی پایین است، اما وقتی تمامی انواع مالفرمیشنها در نظر گرفته شوند، تخمین زده میشود که حدود یک تا یکونیم درصد جمعیت ممکن است درجاتی از این اختلال را داشته باشند. برخی ضایعات مانند لکههای مویرگی (port-wine stain) بسیار شایعتر هستند، در حالی که مالفرمیشنهای شریانی-وریدی (AVM) یا ترکیبی بسیار نادر و اغلب با عوارض شدید همراهند. بیشتر ضایعات در بدو تولد یا اوایل کودکی آشکار میشوند، اما تظاهرات دیررس نیز وجود دارد. بار اقتصادی و اجتماعی این بیماریها قابل توجه است، زیرا علاوه بر درمانهای پیچیده، نیاز به پیگیری مادامالعمر و مراقبتهای چندتخصصی دارند.
جنینشناسی و پاتوفیزیولوژی مولکولی
شبکه عروقی جنین از طریق فرایندهای واژوژنز و آنژیوژنز ساخته میشود. هرگونه اختلال در این مراحل میتواند منجر به ناهنجاری ساختاری شود. در سالهای اخیر کشف جهشهای ژنتیکی سوماتیک و ارثی تحول بزرگی در شناخت این بیماریها ایجاد کرده است. برای نمونه:
- جهش در ژن PIK3CA با طیف وسیعی از سندرمهای overgrowth و مالفرمیشنهای وریدی و لنفاتیک همراه است.
- جهش در ژن TEK/TIE2 با مالفرمیشنهای وریدی مرتبط شناخته شده است.
- جهش در RASA1 و EPHB4 باعث بروز سندرم CM-AVM میشود.
- جهش در GNAQ با لکههای مویرگی و سندرم Sturge–Weber ارتباط دارد.
- جهش در MAP2K1 عامل برخی AVMهای موضعی است.
شناخت این مسیرهای مولکولی باعث شده است تا داروهای هدفمند جدیدی طراحی شوند که درمان بیماری را از مدیریت علائم به کنترل علت مولکولی سوق دهند.
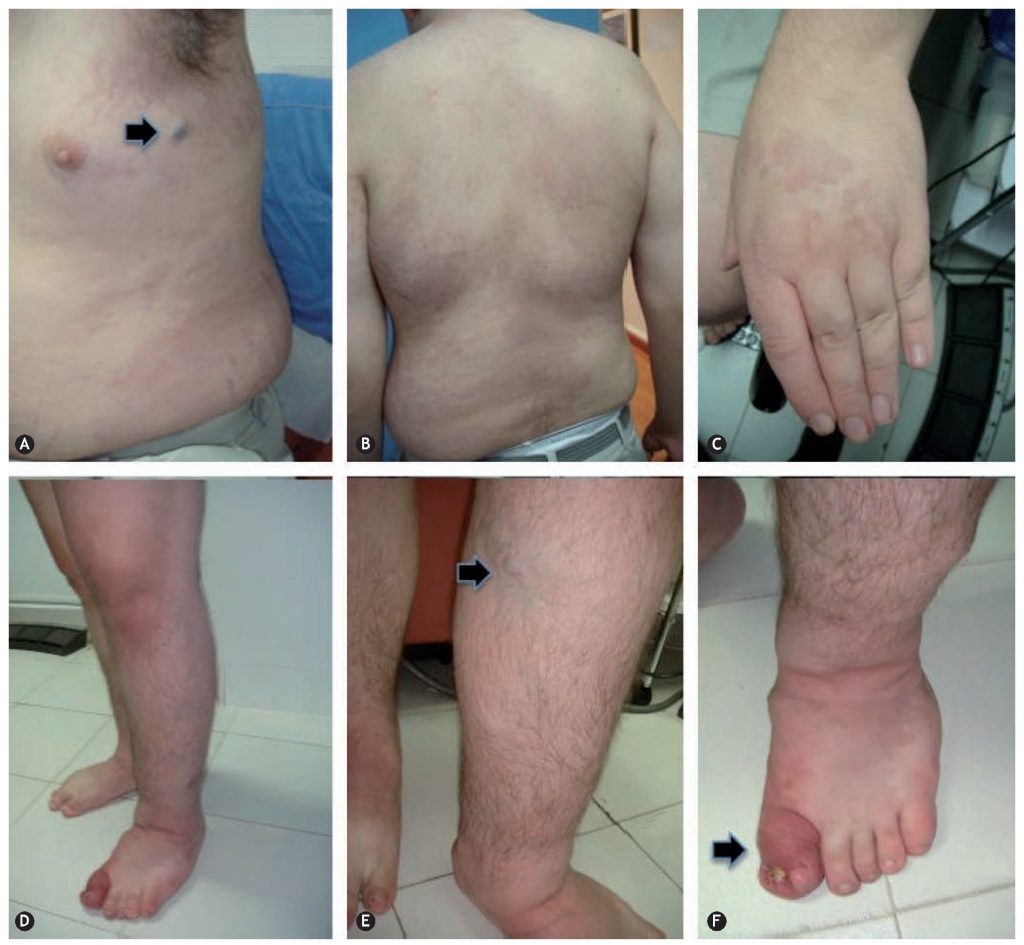
تظاهرات بالینی و تنوع فنوتیپی
علائم بیماران به نوع ضایعه و محل درگیری بستگی دارد.
- مالفرمیشنهای مویرگی معمولاً به صورت لکههای قرمز یا بنفش روی پوست بروز میکنند و گاهی تنها مشکل زیبایی ایجاد میکنند.
- مالفرمیشنهای وریدی اغلب با تودههای نرم، دردناک و کبودشونده همراهاند و در برخی موارد باعث انعقاد داخلعروقی موضعی میشوند.
- مالفرمیشنهای لنفاتیک میتوانند به صورت کیستهای منفرد یا تودههای چندحفرهای ظاهر شوند و گاهی عفونت یا ترشح مکرر دارند.
- AVMها از خطرناکترین انواع هستند که به دلیل جریان بالای خون، ممکن است منجر به خونریزی، تخریب بافت یا حتی نارسایی قلبی شوند.
روشهای تشخیصی
تشخیص صحیح نیازمند تلفیق یافتههای بالینی و تصویربرداری است.
- سونوگرافی داپلر نخستین روش غیرتهاجمی برای بررسی جریان و ساختار است.
- MRI با قدرت بالا بهترین ابزار برای تعیین عمق، حدود و ارتباط ضایعه با بافتهای اطراف است.
- CT یا آنژیوگرافی دیجیتال (DSA) در موارد AVM و برنامهریزی مداخلات ضروری است.
- در برخی موارد آزمایشهای ژنتیکی مولکولی برای تعیین جهش زمینهای و انتخاب درمان هدفمند انجام میشود.
تشخیص افتراقی
تشخیص افتراقی گسترده است و شامل همانژیومها، هماتومهای مزمن، تومورهای نرمتنی، بیماریهای ارثی مانند HHT و سایر سندرمهای overgrowth میشود. افتراق میان ناهنجاریهای عروقی و تومورهای عروقی اهمیت بالینی زیادی دارد، زیرا رویکرد درمانی کاملاً متفاوت است.
درمانهای سنتی
گزینههای درمانی کلاسیک شامل:
- پروپرانولول بهعنوان خط اول درمان در همانژیومهای نوزادی که اثربخشی آن در کارآزماییهای بزرگ ثابت شده است.
- سکلروتراپی برای مالفرمیشنهای وریدی و لنفاتیک که با مواد مختلفی مانند اتانول یا پولیدوکسانول انجام میشود.
- امبولیزاسیون در AVMها که معمولاً پیش از جراحی یا بهعنوان درمان تسکینی استفاده میشود.
- جراحی باز یا لیزری در ضایعات انتخابی، بهویژه ضایعات سطحی یا کوچک.
درمانهای دارویی هدفمند
پیشرفتهای ژنتیکی راه را برای درمانهای هدفمند باز کرده است.
- سیرولیموس (sirolimus)، مهارکننده مسیر mTOR، در مالفرمیشنهای پیچیده و مقاوم به درمان نتایج امیدبخشی داشته است.
- آلپلیسیب (alpelisib)، مهارکننده PI3K، برای بیماران مبتلا به سندرمهای مرتبط با PIK3CA تأییدیه FDA دریافت کرده است.
- مهارکنندههای MEK در مواردی از AVMهای ناشی از جهشهای مسیر MAPK در حال بررسی هستند.
این داروها بهویژه در موارد گسترده و غیرقابل جراحی امید جدیدی برای بیماران ایجاد کردهاند.
عوارض و مراقبت حمایتی
بیماران ممکن است دچار مشکلاتی مانند انعقاد داخلعروقی موضعی، خونریزی مکرر، عفونت، درد مزمن یا محدودیت عملکردی شوند. مدیریت حمایتی شامل کنترل درد، مراقبت پوستی، فیزیوتراپی، درمان ضدانعقاد در موارد انتخابی و حمایت روانشناختی است.
نقش تیم چندتخصصی
مدیریت موفق این بیماران نیازمند همکاری نزدیک جراحان عروق، رادیولوژیستهای مداخلهای، متخصصان پوست، جراحان پلاستیک، ژنتیکدانان بالینی، فیزیوتراپیستها و روانشناسان است. تنها در قالب چنین تیمی میتوان مراقبتی جامع و مبتنی بر شواهد ارائه کرد.
چشماندازهای آینده
پژوهشهای جاری بر روی مسیرهای مولکولی جدید، استفاده از روشهای تصویربرداری پیشرفته و طراحی داروهای هدفمند نسل بعدی نویدبخش بهبود قابل توجه کیفیت زندگی بیماران است. آینده مدیریت ناهنجاریهای عروقی به سمت درمانهای شخصیسازیشده بر اساس ژنوتیپ و فنوتیپ حرکت میکند.
جمعبندی
ناهنجاریهای مادرزادی عروقی گروهی متنوع و پیچیده از اختلالات هستند که تشخیص و درمان صحیح آنها نیازمند درک عمیق از جنینشناسی، ژنتیک، تصویربرداری و رویکرد چندتخصصی است. پیشرفتهای اخیر در طبقهبندی، تصویربرداری و بهویژه درمانهای هدفمند دارویی، چشمانداز مدیریت این بیماران را دگرگون کرده است.
منابع
- ISSVA. Classification of Vascular Anomalies. International Society for the Study of Vascular Anomalies.
- Mulliken JB, Glowacki J. Hemangiomas and vascular malformations in infants and children: a classification based on endothelial characteristics. Plast Reconstr Surg. 1982.
- Lee BB, Baumgartner I, et al. Contemporary diagnosis and management of venous malformations. J Vasc Surg. 2015.
- Léauté-Labrèze C, et al. Propranolol for severe hemangiomas of infancy. N Engl J Med. 2008.
- Adams DM, Trenor CC, et al. Efficacy and safety of sirolimus in the treatment of complicated vascular anomalies. Pediatrics. 2016.
- Venot Q, et al. Alpelisib for PIK3CA-related overgrowth spectrum. Nature. 2018.
- Dompmartin A, Vikkula M, Boon LM. Venous malformation: update on aetiopathogenesis, diagnosis and management. Phlebology. 2010.
- Wassef M, Blei F, Adams D, et al. Vascular anomalies classification: recommendations from the International Society for the Study of Vascular Anomalies. Pediatrics. 2015.
- Hammer J, Seront E, et al. Sirolimus is efficacious in treatment for extensive and/or complex slow-flow vascular malformations: long-term results. J Vasc Surg. 2018.
- Fishman SJ, Mulliken JB. Vascular anomalies: a primer for pediatricians. Curr Opin Pediatr. 2013.
- Cahill AM, Nijs E. Pediatric vascular malformations: pathophysiology, diagnosis, and the role of interventional radiology. Cardiovasc Intervent Radiol. 2011.
- Uller W, Alomari AI, Richter GT. Interventional management of lymphatic malformations. Semin Pediatr Surg. 2014.
- Perkins JA, et al. Current treatment of lymphatic malformations: sclerotherapy and beyond. Plast Reconstr Surg. 2016.
- Parker VE, et al. PIK3CA-related overgrowth spectrum: diagnostic and management challenges. Front Pediatr. 2019.
- Nikolaev SI, et al. Somatic MAP2K1 mutations in human arteriovenous malformations of the brain. N Engl J Med. 2018.
