مقدمه
دستگاه گردش خون انسان شامل شبکهای پیچیده از سرخرگها، سیاهرگها و مویرگهاست که وظیفهٔ حیاتی انتقال اکسیژن، مواد مغذی و دفع مواد زاید را بر عهده دارد. هرگونه اختلال در این چرخهٔ پویا میتواند پیامدهای قابلتوجهی بر سلامت عمومی بگذارد. یکی از مهمترین این اختلالات، تشکیل لخته در وریدهای عمقی اندامها، بهویژه اندام تحتانی است که به آن ترومبوز ورید عمقی یا DVT گفته میشود. این بیماری نهتنها یک مشکل موضعی در سیستم وریدی محسوب میشود، بلکه بهدلیل خطر بالقوهٔ آمبولی ریه (Pulmonary Embolism) اهمیت ویژهای دارد؛ عارضهای که در صورت عدم تشخیص و درمان بهموقع میتواند منجر به مرگ ناگهانی شود.
DVT یک مشکل شایع اما اغلب پنهان در طب بالینی است و بسیاری از بیماران ممکن است تا بروز عوارض شدید، هیچ علامت مشخصی نداشته باشند. اهمیت آگاهی از این بیماری از آن جهت است که بخش قابلتوجهی از موارد، قابل پیشگیری و قابل درمان زودهنگام هستند؛ اما تأخیر در تشخیص یا مداخلات ناقص میتواند منجر به پیامدهای طولانیمدت نظیر سندرم پس از ترومبوز (Post-thrombotic Syndrome) شود. در دهههای اخیر، با پیشرفت روشهای تصویربرداری و دارودرمانی، درک ما از پاتوفیزیولوژی، عوامل خطر، و درمان DVT بهطور چشمگیری افزایش یافته است، اما همچنان چالشهای متعددی در زمینهٔ تشخیص زودرس، پیشگیری هدفمند، و مدیریت بیماران پرخطر باقی مانده است.
تاریخچه و اهمیت بالینی
مفهوم ترومبوز وریدی به قرن نوزدهم بازمیگردد، زمانی که رودولف ویرشو (Rudolf Virchow) سهگانهٔ معروف خود را برای توصیف عوامل مستعدکنندهٔ تشکیل لخته ارائه کرد: اختلال در جریان خون، آسیب دیوارهٔ عروقی، و افزایش تمایل به انعقاد خون. این سهگانه که امروزه با عنوان Virchow’s Triad شناخته میشود، همچنان پایهٔ تئوریک فهم ما از پاتوفیزیولوژی DVT محسوب میشود.
در گذشته، بسیاری از موارد ترومبوز وریدی تنها در مراحل پیشرفته و با بروز آمبولی ریه تشخیص داده میشدند. با پیشرفت ابزارهای تصویربرداری غیرتهاجمی نظیر Doppler Ultrasound و نیز افزایش آگاهی عمومی و پزشکی، امکان تشخیص زودهنگام فراهم شده و در نتیجه میزان مرگومیر ناشی از آمبولی ریه در جوامع پیشرفته کاهش یافته است.
از منظر بهداشت عمومی، DVT یکی از دلایل مهم بستری مجدد بیماران پس از جراحیهای بزرگ محسوب میشود. همچنین، در پروازهای طولانیمدت، بیحرکتی طولانی و شرایط خاص مانند بارداری و بدخیمیها، خطر وقوع DVT بهطور معنیداری افزایش مییابد. همین موضوع سبب شده است که در راهنماهای بینالمللی، پیشگیری از DVT جایگاه ویژهای در مراقبتهای قبل و بعد از اعمال جراحی پیدا کند.
اپیدمیولوژی و عوامل خطر
برآورد میشود که سالانه میلیونها نفر در سراسر جهان دچار نوعی از ترومبوز وریدی شوند. بروز DVT در جوامع مختلف متفاوت است، اما آمارها نشان میدهد که در کشورهای توسعهیافته، میزان بروز سالانه بین ۱ تا ۲ مورد در هر ۱۰۰۰ نفر جمعیت است. شیوع با افزایش سن بیشتر میشود و بیشترین میزان در دهههای ششم و هفتم زندگی دیده میشود. با این حال، DVT منحصر به سالمندان نیست و در جوانان نیز، بهویژه در شرایط خاص، قابل مشاهده است.
عوامل خطر را میتوان به دو دستهٔ کلی اکتسابی و ژنتیکی تقسیم کرد.
از مهمترین عوامل اکتسابی میتوان به موارد زیر اشاره کرد:
- بیحرکتی طولانی (مانند بستری شدن طولانی، سفرهای هوایی طولانی)
- جراحیهای بزرگ، بهویژه ارتوپدی و لگنی
- تروما
- بدخیمیها و درمانهای ضدسرطانی
- بارداری و دوره پس از زایمان
- استفاده از داروهای هورمونی (مانند قرصهای ضدبارداری خوراکی)
- چاقی و سندرم متابولیک
از سوی دیگر، برخی افراد بهطور ژنتیکی مستعد تشکیل لخته هستند؛ اختلالاتی مانند Factor V Leiden mutation، Prothrombin gene mutation، کمبود پروتئین C، پروتئین S یا آنتیترومبین از جمله موارد مهم محسوب میشوند. ترکیب عوامل اکتسابی و ژنتیکی خطر را بهشدت افزایش میدهد؛ مثلاً فردی با جهش Factor V Leiden که پس از جراحی ارتوپدی بیحرکت میماند، در معرض خطر بسیار بالایی برای DVT قرار میگیرد.
پاتوفیزیولوژی
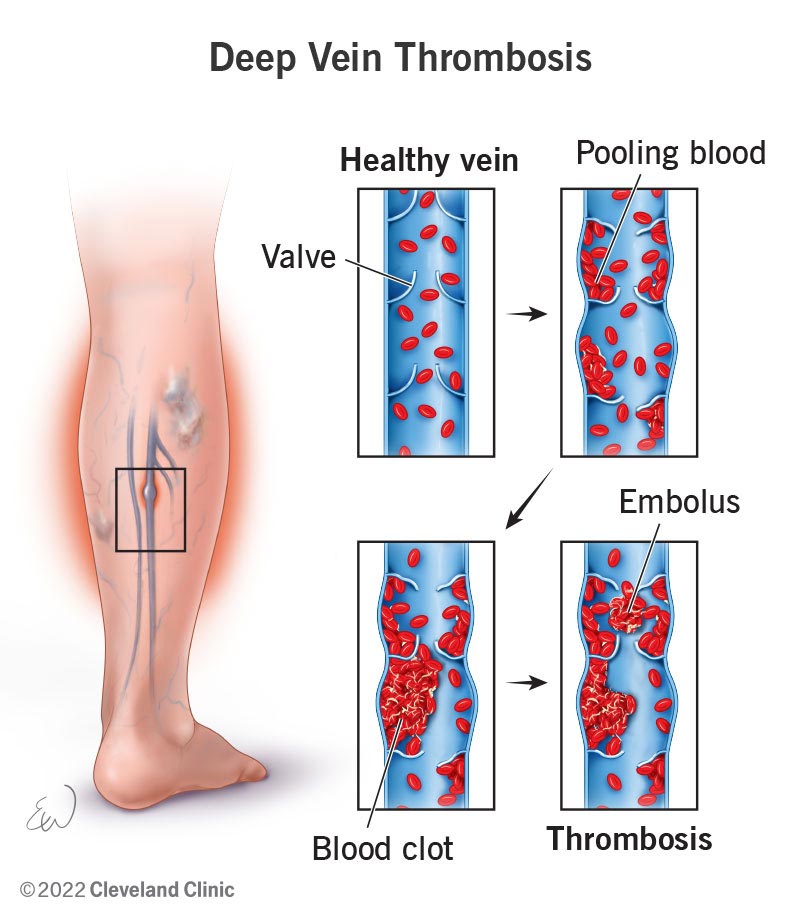
تشکیل ترومبوز در وریدهای عمقی نتیجهٔ تعامل پیچیدهٔ بین جریان خون، عناصر سلولی، فاکتورهای انعقادی و دیوارهٔ عروقی است. برخلاف شریانها که فشار خون بالا و جریان سریع دارند، وریدها بهطور طبیعی دارای جریان آهستهتر هستند. این ویژگی باعث میشود که در شرایطی نظیر بیحرکتی، جریان خون بیش از پیش کند شود و محیط مستعدی برای تجمع پلاکتها و فاکتورهای انعقادی ایجاد گردد.
آسیب به اندوتلیوم وریدی – چه بهدلیل تروما، چه جراحی، یا تهاجم تومور – سبب آزاد شدن فاکتورهای بافتی و فعال شدن مسیرهای انعقادی میشود. در عین حال، وضعیتهای افزایش تمایل به انعقاد (مانند بارداری یا اختلالات ژنتیکی) با تغییر تعادل بین فاکتورهای پروترومبوتیک و آنتیترومبوتیک، زمینه را برای لخته شدن فراهم میکنند.
لختههای اولیه معمولاً در دریچههای وریدی تشکیل میشوند، جایی که جریان خون طبیعی بهطور فیزیولوژیک کاهش مییابد. با رشد لخته، میتواند به قسمتهای بالاتر گسترش یابد و در صورت جدا شدن، از طریق جریان وریدی به سمت ریه حرکت کرده و باعث آمبولی ریه شود؛ این پدیده شایعترین و خطرناکترین عارضهٔ DVT محسوب میشود.
تظاهرات بالینی
تظاهرات بالینی ترومبوز ورید عمقی طیف وسیعی را در بر میگیرد؛ از موارد کاملاً بدون علامت تا فرمهای شدید با خطر بالای آمبولی ریه. بیشتر بیماران با علائم تدریجی مراجعه میکنند و کمتر پیش میآید که علائم بهصورت ناگهانی بروز کنند. شایعترین تظاهرات شامل تورم اندام، درد مبهم یا فشارنده در ساق یا ران، گرمی پوست، و قرمزی یا تغییر رنگ پوست ناحیه درگیر است. این علائم معمولاً در یک پا ظاهر میشوند و در موارد دوطرفه باید به علل زمینهای خاص مانند اختلالات انعقادی یا بدخیمیها شک کرد.
یکی از یافتههای بالینی کلاسیک، علامت هومان (Homan’s sign) است؛ به این صورت که با دورسیفلکشن ناگهانی پا، درد در ناحیهٔ ساق ایجاد میشود. اگرچه این علامت در گذشته بسیار مورد توجه بود، اما امروزه به دلیل حساسیت و ویژگی پایین، بهتنهایی ارزش تشخیصی ندارد و تنها میتواند بخشی از ارزیابی فیزیکی اولیه باشد.
در موارد شدید، ممکن است ترومبوز منجر به انسداد کامل جریان وریدی شود و تابلوی بالینی خطرناکی تحت عنوان Phlegmasia cerulea dolens بروز کند که با تورم شدید، سیانوز و درد قابلتوجه مشخص میشود و در صورت عدم مداخلهٔ فوری میتواند به نکروز اندام منجر شود.
نکته مهم این است که درصد قابل توجهی از بیماران ممکن است هیچ علامت مشخصی نداشته باشند و تنها نشانهٔ اولیه، بروز آمبولی ریه باشد. به همین دلیل، در بیماران پرخطر، غربالگری فعال با روشهای تصویربرداری نقش مهمی در پیشگیری از عوارض دارد.
تشخیص
تشخیص DVT بر اساس ترکیبی از ارزیابی بالینی، تستهای آزمایشگاهی و تصویربرداری انجام میشود. نخستین مرحله، تخمین احتمال بالینی بیماری است. یکی از روشهای متداول، استفاده از Wells Score است که بر پایهٔ عوامل خطر و یافتههای بالینی، احتمال DVT را به سه دستهٔ پایین، متوسط و بالا تقسیم میکند. این مرحله اهمیت زیادی دارد زیرا راهنمای انتخاب تستهای تشخیصی بعدی خواهد بود.
در بیماران با احتمال پایین تا متوسط، اندازهگیری D-dimer بسیار کاربردی است. D-dimer محصول تجزیه فیبرین است و افزایش آن میتواند نشانگر وجود ترومبوز فعال باشد. تست D-dimer حساسیت بالایی دارد، بنابراین مقدار نرمال آن عملاً میتواند DVT را رد کند. با این حال، ویژگی آن پایین است و بسیاری از شرایط مانند عفونت، بدخیمی یا جراحی اخیر نیز میتوانند سطح آن را افزایش دهند.
اولتراسونوگرافی داپلر (Duplex Doppler Ultrasound) ستون اصلی تشخیص DVT محسوب میشود. این روش غیرتهاجمی، در دسترس، و نسبتاً ارزان است و میتواند با دقت بالا انسداد وریدی را نشان دهد. معیار اصلی، عدم فشرده شدن ورید در محل مورد بررسی است؛ در شرایط نرمال، اعمال فشار پروب باید باعث فشرده شدن کامل ورید شود، در حالی که در حضور لخته، این اتفاق نمیافتد. دقت داپلر در وریدهای پروگزیمال (فمورال و پوپلیتهآل) بسیار بالا است، اما حساسیت آن برای وریدهای عمقی دیستال کمتر میباشد.
در مواردی که نتایج داپلر قطعی نباشد یا محل ترومبوز در لگن و نواحی مرکزیتر باشد، از CT Venography یا MR Venography استفاده میشود. این روشها دقت بسیار بالایی دارند اما بهطور معمول برای همه بیماران به کار نمیروند و بیشتر در موارد پیچیده یا هنگام برنامهریزی برای مداخلات درمانی استفاده میشوند.
درمان
درمان ترومبوز ورید عمقی با دو هدف اصلی دنبال میشود: جلوگیری از گسترش لخته و آمبولی ریه و پیشگیری از عوارض مزمن مانند سندرم پس از ترومبوز. انتخاب درمان مناسب بستگی به محل درگیری، شدت بیماری، وضعیت عمومی بیمار و عوامل زمینهای دارد.
درمان دارویی
پایهٔ اصلی درمان، استفاده از داروهای ضدانعقاد است. درمان معمولاً با Heparin یا Low Molecular Weight Heparin (LMWH) آغاز میشود. LMWH بهدلیل تزریق زیرجلدی، دوز ثابت و عدم نیاز به پایش مداوم، در بسیاری از بیماران ترجیح داده میشود. در برخی موارد از Unfractionated Heparin داخل وریدی استفاده میشود، بهویژه در بیماران با نارسایی کلیوی یا نیاز به کنترل دقیقتر.
پس از مرحلهٔ اولیه، درمان به داروهای خوراکی ضدانعقاد منتقل میشود. Warfarin سالها درمان استاندارد بود و نیاز به تنظیم دقیق دوز بر اساس INR دارد. در سالهای اخیر، داروهای خوراکی نوین موسوم به Direct Oral Anticoagulants (DOACs) مانند Rivaroxaban، Apixaban و Dabigatran بهطور گسترده جایگزین شدهاند؛ این داروها اثربخشی مشابه یا بالاتر و خطر خونریزی کمتر داشته و نیازی به پایش مداوم ندارند.
مدت زمان درمان معمولاً بین ۳ تا ۶ ماه است، اما در بیماران با عوامل خطر مداوم یا اختلالات انعقادی ارثی ممکن است درمان طولانیمدت یا حتی مادامالعمر لازم باشد. تصمیمگیری در این مورد باید با ارزیابی دقیق خطر عود ترومبوز و خطر خونریزی انجام شود.
مداخلات اندوواسکولار و جراحی
در موارد خاص، مانند ترومبوزهای گستردهٔ ایلیوفمورال یا وجود علائم شدید تهدیدکنندهٔ اندام، ترومبولیز داخل وریدی یا ترومبکتومی مکانیکی ممکن است مورد استفاده قرار گیرد. این روشها با هدف حذف مستقیم لخته و بازگرداندن سریع جریان خون انجام میشوند تا از بروز آسیبهای بلندمدت جلوگیری شود. البته این روشها فقط در مراکز تخصصی و برای بیماران منتخب بهکار میروند.
در بیمارانی که ضدانعقاد برایشان ممنوع است (مثلاً بهدلیل خونریزی فعال)، ممکن است از فیلتر ورید اجوف تحتانی (IVC filter) استفاده شود تا از حرکت لخته به سمت ریه جلوگیری شود. استفاده از این فیلترها باید موقت باشد و پس از رفع منع درمان ضدانعقادی، فیلتر خارج شود.
پیشگیری
پیشگیری از ترومبوز ورید عمقی یکی از ارکان مهم مدیریت بیماران پرخطر است و شامل اقدامات غیر دارویی و دارویی میشود.
از مهمترین اقدامات مکانیکی میتوان به جورابهای ضد آمبولی (Compression Stockings) و وسایل پمپکنندهٔ ساق پا اشاره کرد. این ابزارها با افزایش جریان خون و کاهش رکود وریدی، احتمال تشکیل لخته را کاهش میدهند. همچنین تشویق به تحرک زودهنگام پس از جراحی و پرهیز از بیحرکتی طولانی، به ویژه در بیماران بستری، نقش پیشگیرانهٔ بسیار مهمی دارد.
در پیشگیری دارویی، LMWH و DOACs در بیماران جراحی بزرگ یا بستری در ICU استفاده میشوند. برای بیماران با سابقهٔ قبلی DVT یا عوامل خطر شدید، درمان پروفیلاکسی بلندمدت ممکن است مدنظر قرار گیرد. در پروازهای طولانی یا سفرهای بیحرکت، توصیه به تحرک منظم و استفاده از جورابهای فشاری موثر است.
آگاهی و آموزش بیماران و مراقبان نقش مهمی در پیشگیری از DVT دارد. اطلاعرسانی دربارهٔ علائم هشداردهنده، اهمیت تحرک و رعایت دقیق دارودرمانی، احتمال بروز عوارض را به میزان قابل توجهی کاهش میدهد.
عوارض و پیامدها
شایعترین و خطرناکترین عارضهٔ DVT، آمبولی ریه (Pulmonary Embolism) است که در صورت درمان نشدن میتواند کشنده باشد. شدت و محل ترومبوز، احتمال وقوع PE را تعیین میکند؛ ترومبوزهای پروگزیمال بیشترین خطر را دارند.
یکی دیگر از عوارض مهم، سندرم پس از ترومبوز (Post-thrombotic Syndrome) است. این سندرم با علائمی نظیر تورم مزمن، درد، تغییر رنگ پوست و ایجاد وریدهای واریسی مشخص میشود و میتواند کیفیت زندگی بیماران را به شدت کاهش دهد. پیشگیری مناسب و درمان سریع DVT، شانس بروز این عارضه را کاهش میدهد.
عود DVT نیز یک مشکل بالینی مهم است. بیماران با عوامل خطر مداوم یا اختلالات ژنتیکی انعقادی، حتی پس از درمان کامل، در معرض ریسک بالای عود قرار دارند. بنابراین پایش طولانیمدت و ارزیابی دورهای بیماران الزامی است.
چشمانداز آینده و پژوهشهای نوین
پیشرفتهای اخیر در زمینه DVT شامل داروهای ضدانعقاد هدفمند، روشهای تصویربرداری پیشرفته و مدیریت شخصیشده بیماران پرخطر است. داروهای جدید DOAC، علاوه بر اثربخشی بالا، نیاز به پایش مداوم ندارند و خطر خونریزی را کاهش میدهند.
تحقیقات در زمینه نشانگرهای زیستی (Biomarkers) و تصویربرداری مولکولی، امکان تشخیص زودهنگام لختههای کوچک یا غیرمعمول را فراهم کرده است. در آینده، ترکیب این فناوریها با مدلهای پیشبینی ریسک شخصی میتواند راهبرد پیشگیری و درمان را متحول کند.
پژوهشهای بالینی در حال بررسی ترومبولیز انتخابی و مداخلات اندوواسکولار کمتهاجمی برای کاهش عوارض بلندمدت هستند. این مطالعات نشان میدهند که در بیماران منتخب، حذف سریع لخته میتواند ریسک سندرم پس از ترومبوز را کاهش دهد و کیفیت زندگی را بهبود بخشد.
جمعبندی
ترومبوز ورید عمقی یک بیماری بالینی شایع و بالقوه تهدیدکنندهٔ زندگی است که نیازمند تشخیص زودهنگام، درمان مناسب و پیشگیری هدفمند است. شناسایی بیماران پرخطر، استفاده از روشهای تصویربرداری دقیق، درمان دارویی و در موارد خاص مداخلات اندوواسکولار، ستونهای مدیریت موفق DVT را تشکیل میدهند.
آگاهی عمومی و آموزش بیماران دربارهٔ علائم هشداردهنده، اهمیت تحرک و رعایت دقیق دارودرمانی نقش مهمی در کاهش عوارض و مرگومیر ناشی از این بیماری دارد. با پیشرفت داروها، فناوریهای تصویربرداری و پژوهشهای نوین، آیندهٔ مدیریت DVT به سمت تشخیص زودهنگام و درمان شخصیشده در حرکت است و امید میرود بتوان بار بیماری و عوارض بلندمدت آن را بهطور قابل توجهی کاهش داد.
منابع
- Kearon C, Akl EA, Ornelas J, et al. Antithrombotic Therapy for VTE Disease: CHEST Guideline and Expert Panel Report. 2016;۱۴۹(۲):۳۱۵-۳۵۲.
- Konstantinides SV, Meyer G, Becattini C, et al. ۲۰۱۹ ESC Guidelines for the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2020;41(4):543–۶۰۳.
- Heit JA. Epidemiology of venous thromboembolism. Nat Rev Cardiol. 2015;12(8):464–۴۷۴.
- Goldhaber SZ, Bounameaux H. Pulmonary embolism and deep vein thrombosis. 2012;۳۷۹(۹۸۲۸):۱۸۳۵–۱۸۴۶.
- Gould MK, et al. Prevention of VTE in nonorthopedic surgical patients. 2012;۱۴۱(2_suppl):e195S–e226S.
- Baglin T, et al. Guidelines on oral anticoagulation with warfarin—third edition. Br J Haematol. 2012;158(3):311–۳۲۴.
- Prandoni P, et al. Long-term outcomes after deep vein thrombosis. 2004;۱۱۰(۱۸):۲۷۹۰–۲۷۹۵.
- Kearon C, et al. Direct oral anticoagulants for the treatment of venous thromboembolism: guidance from the American Society of Hematology. Blood Adv. 2020;4(19):4690–۴۷۰۳.
